
Anthony Lemarié
Cette équipe de recherche translationnelle, dans le cadre de ses travaux sur la radiosensibilisation des glioblastomes, a mis en place un nouvel axe de recherche sur l’implication des cellules souches de Glioblastome dans la radiorésistance de ces tumeurs. Ce groupe a initié dès 2010 un projet centré sur la plasticité des cellules de Glioblastome en réponse à la radiothérapie, plasticité pouvant expliquer leur radiorésistance et la présence systématique de récidive, même après résection chirurgicale et radio/chimiothérapie. Il a pu mettre en évidence que les rayonnements ionisants entraînent dans les cellules de Glioblastome de patients une plasticité phénotypique et métabolique ainsi que l’acquisition de caractères et fonctions propres aux cellules souches cancéreuses, un phénomène appelé dédifférenciation (Dahan et al 2014 PMID: 25429620). Les recherches de ce groupe se sont axées sur l’identification de nouvelles cibles radiosensibilisantes spécifiques à ces cellules souches de Glioblastome en identifiant notamment l’intégrine b8 (Malric et al 2017 & 2019, PMID: 29156849 et PMID: 30266751) ainsi que la survivine (Dahan et al 2014 PMID: 25429620).
L’axe de recherche développé aujourd’hui s’intéresse à l’étude de l’hétérogénéité tumorale intra-patient et à son rôle dans la radiorésistance (Boyrie et al 2018, PMID: 30333910). Il a été mis en evidence par l’équipe que des zones métaboliquement actives de la tumeur définies en Spectroscopie de résonnance magnétique (IRM spectroscopie) chez les patients porteurs de gliobalstome (Laprie et al, 2008 PMID: 18262090; Deviers et al 2014 PMID: 25104068) , connues pour être des sites spécifiques de récidive tumorale, étaient enrichies en cellules souches de Glioblastome (Lemarié et al en préparation). Ce projet porte donc sur cette hétérogénéité intra-tumorale afin de caractériser les cellules souches cancéreuses issues de ces zones et d’établir leur profil de radiorésistance, leur profil transcriptomique (RNAseq), et leur profil métabolique (analyse du métabolome, analyseur de flux Seahorse), à la fois in vitro et in vivo (méthode de spectroscopie IRM). L’objectif de ce projet est d’identifier des cibles métaboliques spécifiques à ces cellules souches de Glioblastome afin de mieux radiosensibiliser ces zones métaboliquement actives chez le patient et de bloquer ainsi la récidive tumorale.
Mots clés
Métabolisme, plasticité, dédifférenciation, cellules souches de Glioblastome, hétérogénéité tumorale
Partenaires et financeurs
Ligue contre le Cancer (Tarn, Hautes-Pyrénées), ARTC, FRM, INCA Plan Cancer, canceropôle GSO
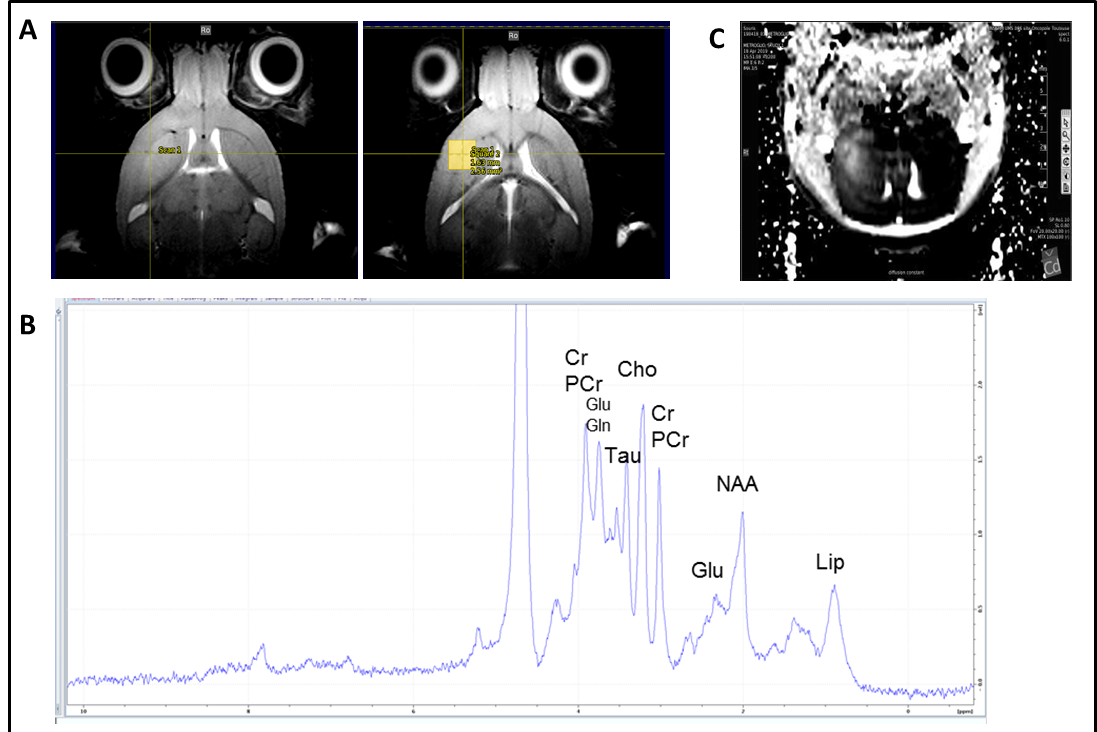
Spectroscopie IRM et IRM multimodale chez la souris xénogreffée en orthotopie par des cellules souches de glioblastome (GB) générée à partir de patients atteinds de GB. Après la croissance de la tumeur, le cerveau de la souris a été soumis à l’IRM multimodale et à la spectroscopie IRM. Séquences d’imagerie IRM montrant une zone tumorale d’hyperintensité et délimitation de la zone (voxel) soumise à la spectroscopie IRM (à droite). (B) Spectre de spectroscopie IRM du voxel tumoral défini en (A) avec les pics des différents métabolites mis en évidence. (C) Séquence d’imagerie IRM de diffusion montrant une zone d’hyperdiffusion dans la région tumorale. Collaboration avec F. Desmoulin, plateforme d’imagerie du petit animal, UMS006 CREFRE , Toulouse / MRI and multimodal MRI spectroscopy in mice orthotopically xenografted with glioblastoma (GB) stem cells generated from GB patients. After tumor growth, the mouse brain was subjected to multimodal MRI and MRI spectroscopy. MRI imaging sequences showing a tumor area of hyperintensity and delineation of the area (voxel) subjected to MRI spectroscopy (right). (B) MRI spectroscopy spectrum of the tumor voxel defined in (A) with the peaks of the different metabolites highlighted. (C) Diffusion MRI imaging sequence showing an area of hyperdiffusion in the tumor region. Collaboration with F. Desmoulin, small animal imaging platform, UMS006 CREFRE, Toulouse

