
VERONIQUE GIGOUX
Nanothérapies Ciblées Appliquées À L’adénocarcinome Pancréatique
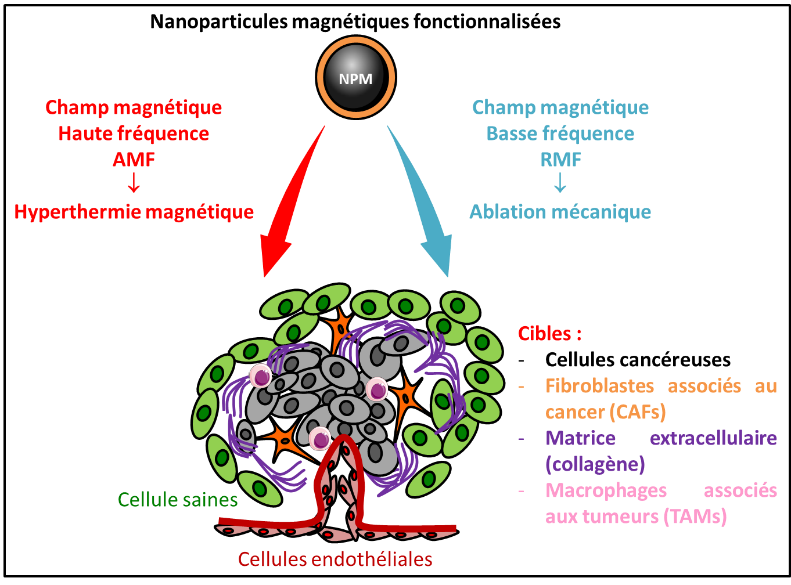
Certains récepteurs/protéines, surexprimés par les cellules tumorales ou présents dans le microenvironnement tumoral, peuvent constituer des cibles pour développer de nouvelles stratégies thérapeutiques, notamment des approches de nanothérapies ciblées basées sur l’utilisation de nanoparticules vectorisées. Les nanoparticules magnétiques offrent de nouvelles opportunités pour l’imagerie tumorale et la thérapie anti-cancéreuse.
Nos connaissances sur la pharmacologie du récepteur de la cholécystokinine de type 2 (RCCK2), sa surexpression dans certaines tumeurs, ainsi que ses propriétés d’internalisation, nous ont permis d’établir des preuves de concept pour le développement de stratégies de nanothérapies ciblées. Des nanoparticules magnétiques d’oxyde de fer (NPMs) (approuvée pour usage médical comme agent de contraste en imagerie), décorée de gastrine (agoniste spécifique du RCCK2) pour le ciblage et d’une sonde fluorescente pour leur détection, reconnaissent spécifiquement les cellules exprimant le RCCK2, s’internalisent et s’accumulent dans les lysosomes des cellules ciblées.
La première stratégie développée consiste à éradiquer les cellules par hyperthermie magnétique ciblée. L’application d’un champ magnétique alternatif à haute fréquence (AMF) induit la mort des cellules tumorales ou du microenvironnement ayant internalisé les nanoparticules fonctionnalisées selon un mécanisme de mort lysosomale (Sanchez 2014). La mort cellulaire est initiée dans les lysosomes : le mécanisme implique une élévation de température à la surface des NPMs qui génère la production d’espèces réactives de l’oxygène (ROS), conduisant à la perméabilisation de la membrane lysosomale et la fuite d’enzymes lysosomales, dont la Cathepsine B, dans le cytosol. La Cathepsine B active alors une voie de mort cellulaire non-apoptotique dépendante de la Caspase-1 (Connord 2015 Hallali 2016, Clerc 2018). Cette approche d’hyperthermie magnétique ciblée agit en synergie avec un traitement chimiothérapeutique pour éradiquer plus efficacement les cellules tumorales, en activant deux voies de mort cellulaire qui sont respectivement dépendantes de la Caspase-1 et de la Caspase-3 apoptotique (El Hajj Diab 2018).
La seconde stratégie développée très récemment consiste à éradiquer les cellules-cibles par ablation mécanique magnéto-induite et ciblée. Exposées à un champ magnétique rotatif à basse fréquence (RMF), les NPMs génèrent des forces mécaniques capables d’induire la mort de cellules tumorales ou du microenvironnement, et d’inhiber leur prolifération cellulaire.
Nos recherches s’orientent vers la compréhension des mécanismes cellulaires (migration…) et moléculaires (signalisations intracellulaires…) induits par les NPMs exposées aux différents champs magnétiques, l’optimisation de ces stratégies avec de nouvelles générations de NPMs et le ciblage de nouveaux éléments constituant une tumeur (macrophages associés aux tumeurs TAMs, matrice extracellulaire) (Belkahla 2020, Camacho-Fernandez 2021). Parallèlement, nous validerons l’efficacité de ces stratégies dans des études pré-cliniques sur des modèles murins de cancers, en les combinant notamment à des traitements chimiothérapeutiques et/ou radiothérapeutiques.
Financements : H2020-MSCA-ITN, Plan Cancer, Agence Nationale de la Recherche, Ligue Nationale contre le cancer (financement thèse), Ligue régionale contre le cancer, Cancéropôle GSO.
Personnel : Véronique Gigoux (CRCN Inserm), Pascal Clerc (Ingénieur d’Etude Inserm), Justine Journaux (Thèse, LNCC), Ahmed Abdelhamid (Thèse H2020-MSCA-ITN)
Références :
- Camacho-Fernandez JC, Quijano GKG, Severac C, Dague E, Gigoux V, Santoyo-Salazar J, Martinez-Rivas AMR. Nanobiomechanical behavior of Fe3O4@SiO2 and Fe3O4@SiO2-NH2 nanoparticles over HeLa cells interfaces. Nanotechnology (2021).
- Belkahla H, Antunes JC, Lalatonne Y, Sainte Catherine O, Illoul C, Journé C, Jandrot-Perrus M, Coradin T, Gigoux V, Guenin E, Motte L, Helary C. USPIO-PEG nanoparticles functionalized with a highly specific collagen-binding peptide: a step towards MRI diagnosis of fibrosis. J Mater Chem B. (2020).
- El Hajj Diab D, Clerc P, Serhan N, Fourmy D, Gigoux V. Combined treatments of magnetic intra-lysosomal hyperthermia with doxorubicin promotes synergistic anti-tumoral activity. Nanomaterials. 8:468 (2018).
- Clerc P, Jeanjean P, Halalli N, Gougeon M, Pipy B, Carrey J, Fourmy D, Gigoux V. Targeted Magnetic Intra-lysosomal Hyperthermia produces lysosomal reactive oxygen species and causes Caspase-1 dependent cell death. Controlled Release. 270: 120-134 (2018).
- Halalli N, Clerc P, Fourmy D, Gigoux V, Carrey J. Influence on cell death of high frequency motion of magnetic nanoparticles during magnetic hyperthermia experiments. Applied Physics Letters 109 (3): 10.1063 (2016).
- Connord V, Clerc P, Hallali N, El Hajj Diab D, Fourmy D, Gigoux V*, Carrey J*. Real-time Analysis of Magnetic Hyperthermia Experiments on Living Cells under Confocal Microscope. Small 11(20):2437-45 (2015).
- Sanchez C, El Hajj Diab D, Connord V, Clerc P, Meunier E, Pipy B, Payré B, Tan RP, Gougeon M, Carrey J, Gigoux V, Fourmy D. Targeting a G-Protein-Coupled Receptor Overexpressed in Endocrine Tumors by Magnetic Nanoparticles To Induce Cell Death. ACS Nano 8(2):1350-63 (2014).

