
Mécanismes moléculaires et modulation de l’activité des petites GTPases dans le cancer
Stéphanie Cabantous
La plupart des fonctions cellulaires dépendent de la coordination fine de voies de signalisation définies par des réseaux d’interaction complexes. Ces interactions protéine-protéine (IPP) sont souvent spécifiques du contexte et de l’environnement cellulaire. Les IPP jouent un rôle crucial dans la connectivité des réseaux d’interaction en favorisant le maintien de la croissance des cellules cancéreuses et la transmission des signaux oncogéniques qui leur permettent d’acquérir les caractéristiques du cancer. La mise en évidence des variations de l’interactome protéique d’une cellule est d’une importance cruciale pour une meilleure compréhension de la tumorigenèse et de la dérégulation des voies de signalisation dans les cancers.
Méthodologie
Nous avons développé des outils basés sur la complémentation “split-GFP tripartite” qui permettent d’analyser les interactions protéine-protéine à l’échelle de la cellule unique (Cabantous, Nguyen et al. 2013). Nous avons validé cette approche pour l’analyse de l’activation des petites GTPases de la superfamille RAS dans différents modèles de cellules humaines. Dans cet essai, deux fragments de la GFP (green fluorescent protein), les brins s10 et s11 (appelés communément GFP10 et GFP11), sont fusionnés respectivement avec la GTPase et son domaine effecteur correspondant. Ces protéines de fusion (GFP10-GTPase et domaine effecteur-GFP11) sont co-exprimées avec le fragment détecteur GFP1-9 de la GFP. C’est seulement lorsque la GTPase est liée au GTP en conformation active que l’association au domaine effecteur se produit, rapprochant ainsi les brins GFP10 et GFP11 et permettant la complémentation avec GFP1-9 pour reconstituer une GFP fluorescente (Figure 1). Nous avons validé la spécificité du signal pour l’étude de l’activation des GTPases RHO et RAS (Koraichi, Gence et al. 2018) et nous avons mis au point des modèles cellulaires optimisés afin d’effectuer des mesures d’interactions dans un format miniaturisé (Cabantous, WO2016207313).
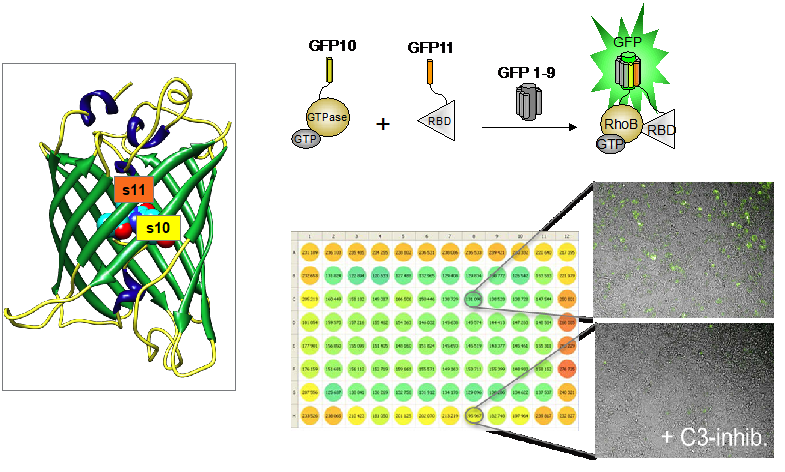
Figure 1. Modèles Split-GFP pour l’analyse des interactions entre protéines de petites GTPases et pour le criblage à haut débit d’inhibiteurs
Axe 1 : Elucidation des mécanismes moléculaires de l’activité des GTPases RhoB dans les thérapies ciblées contre le cancer
Notre activité de recherche principale concerne l’identification des voies de signalisation régulées par les petites GTPases RHO dans l’oncogenèse pulmonaire afin d’identifier de nouveaux acteurs de la résistance dans ces cancers. Nous identifions les effecteurs directs de RHOB par criblage haut-débit de banques de l’ORFéome humain (collaboration Y. Jacob & Caroline Demeret, Institut Pasteur). Ces cibles sont ensuite caractérisées pour leur impact sur la prolifération cellulaire et la modulation des voies de survie cellulaire. La caractérisation moléculaire et cellulaire des candidats complexes est complétée par des études en spectrométrie de masse (Marie-Pierre Bousquet & Julien Marcoux, IPBS, Toulouse), et par leur analyse biophysique et structurale (Pédelacq Jean-Denis, IPBS). L’ensemble de ces données permettra d’une part de déterminer l’architecture de ces complexes et d’identifier les sites d’interactions afin de comprendre les conséquences fonctionnelles de ces interactions, et d’autre part de définir des régulateurs potentiels de ces complexes protéiques qui pourraient servir de cibles pharmacologiques alternatives.
Axe 2 : Criblage d’inhibiteurs de l’activité des GTPases RHO et RAS
Une application importante de ces modèles biosenseurs concerne la recherche d’inhibiteurs de l’activité des petites GTPases. Le développement de telles molécules est encore émergent ou au stade d’utilisation in vitro ou en préclinique, mais pourrait avoir des applications dans de nombreuses pathologies. Notre intérêt porte tout particulièrement sur l’étude de l’activation de RHOB pour laquelle nous avons développé un modèle de criblage afin d’identifier des inhibiteurs spécifiques qui pourraient être utilisés dans des modèles de cellules endothéliales dans lesquels RHOB est suractivée en réponse à des cytokines inflammatoires (Marcos-Ramiro, Garcia-Weber et al. 2016). Par ailleurs nous développons des modèles pour la recherche d’inhibiteurs de KRAS dans un contexte d’adénocarcinome bronchique (collaboration D. Santamaria).
Mots-clés :
- split-GFP,
- protéines fluorescentes,
- petites GTPases,
- RHO,
- RAS,
- signalisation cellulaire,
- criblage à haut débit,
- interaction protéine-protéine.
Membres du groupe :
- Sebastian Castillo, doctorant, 3ème année
- Delphine Pagan, Assistant Ingénieur
- Clara Apter, interne en médecine
- Carl Khawly, étudiant en Master2.
Autres membres de l’équipe impliqués :
- Gilles Favre (PU, PH)
- Claire Médale Giamarchi (Ingénieur)
- Rémi Gence (Assistant Ingénieur)
Principales collaborations externes :
- Jean Denis Pédelacq, Groupe de Biologie Structurale, IPBS, Toulouse
- Marie Pierre Bousquet, Spectrométrie de masse, IPBS, Toulouse
- Caroline Demeret, Interactomique des virus, Institut Pasteur
- Stanislas Faguer & Muriel Laffargue, Unité de néphrologie-CHU Rangueil, I2MC, Toulouse
- Manos Mavrakis, Institut Fresnel, Marseille
- David Santamaria, Institut de Salamanca, Espagne.
Publications sélectionnées :
Int J Mol Sci. 2019 Jul 15; 20 (14), 3479. DOI: 10.3390/ijms20143479.
Pedelacq JD, Cabantous S.
Development and Applications of Superfolder and Split Fluorescent Protein Detection Systems in Biology. Special Issue Imaging with Fluorescent Proteins.
Methods Mol Biol. 2019 2025:423-437. DOI: 10.1007/978-1-4939-9624-7_20
Pedelacq JD, Waldo GS, Cabantous S.
High-Throughput Protein-Protein Interaction Assays Using Tripartite Split-GFP Complementation.
J Cell Sci. 2018 Jan 1;131(1). DOI: 10.1242/jcs.210419
Koraïchi, F., Gence, R., Bouchenot, C., Grosjean, S., Lajoie-Mazenc, I., Favre, G., Cabantous,
S. High-content tripartite split-GFP cell-based assays to screen for modulators of small GTPase activation.
Sci Rep. 2013 Oct 4;3:2854. https://doi.org/10.1038/srep02854
Cabantous S*, Nguyen HB, Pedelacq JD, Koraïchi F, Chaudhary A, Ganguly K, Lockard MA, Favre G, Terwilliger TC, & Waldo GS* (*co-corresponding authors).
A new protein-protein interaction sensor based on tripartite split-GFP association.
Biotechniques 2010 Oct; 49(4):727-8, 730, 732 passim. doi: 10.2144/000113512. PubMed PMID: 20964633. DOI: 2144/000113512
Kaddoum L, Magdeleine E, Waldo GS, Joly E, Cabantous S.
One-step split GFP staining for sensitive protein detection and localization in mammalian cells.

